Curso de termodinâmica/Termoquímica
A termoquímica
É a aplicação da primeira lei às reações químicas isotermas e isóbaras. O fundamento da termoquímica é a equação , que fornece uma função de estado ligada à energia do sistema e mensurável experimentalmente. É graça às propriedades de função de estado de ou H que não é necessário medir os calores de reação de todas reações possíveis. Como H depende só dos estados inicial e final, poderemos calcular para qualquer reação, simplesmente montando um caminho do estado inicial e para o estado final composto de etapas elementares para quais a mudança de entalpia é conhecida.
Exemplo: procurar a mudança de associada à transformação . É inútil de medir-la se conhecermos já os calores de . Em efeito, como H é uma função de estado, a o mesmo valor que a transformação de A em C seja efetuada diretamente ou passando pelo intermediário B:
Em outras palavras, a mudança de entalpia durante um processo cíclico, por exemplo é nulo, os estados inicias e finais sendo os mesmos:
Para H, como para qualquer função de estado:

Para poder determinar a entalpia de qualquer reação, basta de ter uma coletânea de para reações elementares . Foram escolhidas as reações de formação das moléculas.
Definições
Entalpia de formação de um composto: É o calor liberado ou absorvido ,, quando um mol do composto é formado a partir dos elementos a pressão constante.
Estado: é o estado estável sob 1 bar. Anotado pelo expoente º.
Entalpia de formação padrão: É o calor liberado ou absorvido,, quando há formação de um mol do composto, sob 1 bar e a 298K a partir dos elementos no seus estados padrões.

Por conseqüência, a entalpia padrão de formação dos elementos é nula por definição. As seguintes reações são exemplos de reações de formação padrões:
Lei de Hess
Se conhecermos as entalpias padrões de formação de todos corpos que intervem numa reação química, podemos calcular a entalpia desta reação. Por exemplo, para calcular a entalpia da reação :
a 25°C sob 1 bar, a partir das entalpias padrões de formação de e a 25ºC, basta de construir o seguinte ciclo:
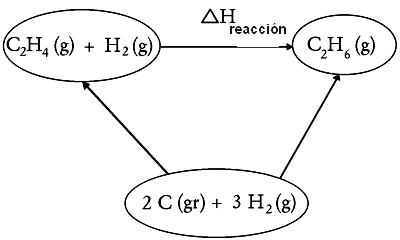
Como H é uma função de estado:
É a formalização da lei de Hess
Efeito da temperatura sobre as entalpias de reação.
Seja uma reação química:
cujo é a entalpia a uma temperatura T. Podemos construir o seguinte ciclo:
Em conseqüência:
Entalpia de combustão
Poucas reações de formação podem ser diretamente estudadas para medir a suas entalpias. Ao contrario, podemos medir facilmente o calor liberado durante a combustão de quase todos os compostos. As entalpias de formação citadas nas tabelas foram calculadas a partir dos valores das entalpias padrões de combustão.Por definição, a entalpia de combustão padrão 25°C é o calor liberado a 25°C sob pressão de 1 bar constante durante a oxidação completa do composto em H2O (l) , CO2 (g), SO2 (g), e N2 (g). Experimentalmente, medimos o calor de combustão em presencia de um excesso de oxigênio, numa bomba calorimétrica, que é um recipiente isolado com volume constante e resistante à pressão.
As reações de combustão são também na origem das chamas. Estas constituem um meio reacional cujo tamanho é limitado não pelas paredes do recipiente mas pelo fornecimento controlado dos reagentes. Podemos calcular a temperatura máxima de uma chama considerando-a como um meio isolado: a reação é feita de maneira adiabática e todo o calor da reação é utilizado para aquecer os produtos.
Calorimetria Adiabática.
A fim de simplificar a determinação das mudanças de energia ou entalpia, as medições termoquímicas são, em geral, conduzidas em condição adiabáticas, por exemplo num calorímetro adiabático seja um recipiente que não permite nenhuma transferência de matéria e de calor. As medições são feitas a pressão e volume constantes, segundo o esquema:
Dependendo das condições da operação, a energia térmica medida Q corresponde a (volume constante) ou a (pressão constante). A etapa de aquecimento pode implicar só os produtos da reação ( combustão numa chama por exemplo), os produtos e o recipiente (bomba calorimétrica, por exemplo) ou ainda os produtos e um constituinte inerte da mistura( solvente por exemplo).
Entalpia de dissolução - Entalpia de atomização
A entalpia de dissociação (chamada as vezes erradamente energia de ligação) é o calor que precisa fornecer para cortar, a pressão constante, as ligações químicas e separar os átomos. Por definição , o reagente contendo as ligações a cortar é a molécula isolada, então no estado gasoso. Exemplos: a entalpia da ligação H-H é a mudança de entalpia durante a reação química:
a entalpia da seguinte reação é igual a 2 entalpias de ligação O-H:
Poderíamos calcular a entalpia de formação de qualquer composto gasoso a partir de uma tabela de entalpia de dissociação . Porém, a entalpia de ligação de uma molécula depende muitas vezes do resto da molécula e os dados das tabelas são valores médios.
A entalpia de atomização padrão de um elemento é o calor que precisa fornecer a uma pressão de 1 bar constante para cortar todas ligações químicas do elemento no seu estado padrão, e formar assim os átomos no estado gasoso. Por exemplo, a reação de atomização da grafite é:

